NETs或成为缓解肿瘤复发转移的重要干预靶点:慢性压力通过中性粒细胞介导的微环境变化促进癌症转移


2024年3月,美国冷泉港实验室肿瘤中心Mikala Egeblad教授团队于《Cancer Cell》(IF=44.5)杂志上发表题为“Chronic stress increases metastasis via neutrophil-mediated changes to the microenvironment”的研究论文。研究结果显示:
①在乳腺癌和胰腺癌小鼠模型中,慢性压力使转移灶数量增加2–5倍,显著促进癌细胞播散和定植;而清除中性粒细胞则可完全阻断压力诱导的转移。
②慢性应激通过激活下丘脑-垂体-肾上腺轴释放糖皮质激素,作用于中性粒细胞的糖皮质激素受体(GR),导致其昼夜节律紊乱并诱导中性粒细胞胞外诱捕网(NETs)形成。
③NETs促进成纤维细胞产生纤连蛋白、抑制T细胞浸润,从而在肺部建立促转移微环境;而GR敲除小鼠或使用DNase I降解NETs均可消除应激诱导的转移。
④活性氧、细胞周期蛋白D3、p38 MAPK激活等机制参与糖皮质激素诱导的NETs形成;使用CDK4/6抑制剂、组织蛋白酶G抑制剂、ROS抑制剂均能有效阻断NETs的生成。
⑤NETs可能成为缓解癌症复发和转移的重要干预靶点。

慢性应激与癌症患者转移风险增加及生存率降低相关,但具体原因尚不明确。我们的研究显示,在小鼠中,慢性应激可使已播散的癌细胞形成的肺转移灶增加2至4倍。慢性应激显著改变肺微环境,表现为纤连蛋白蓄积、T细胞浸润减少以及中性粒细胞浸润增加。清除中性粒细胞可消除应激诱导的转移。慢性应激改变中性粒细胞正常的昼夜节律,并通过糖皮质激素的释放导致中性粒细胞胞外诱捕网(NETs)形成增加。在中性粒细胞特异性糖皮质激素受体敲除的小鼠中,慢性应激无法增加NETs的形成及转移。此外,用DNase I降解NETs可阻止慢性应激诱导的转移。综上,我们的数据表明,慢性应激时释放的糖皮质激素可导致NETs形成,并建立一个促进转移的微环境。因此,NETs可能成为预防癌症患者转移复发的靶点,而许多癌症患者会因自身疾病经历慢性应激。

癌症患者承受着多重严重压力源,包括对预后的焦虑和长达数周的持续治疗。慢性压力是由环境或心理社会因素引发的生理过程,它不仅影响记忆、认知和行为,还会破坏心血管、胃肠及免疫系统的整体稳态。这种压力会激活下丘脑-垂体-肾上腺轴,导致糖皮质激素(人类为皮质醇,小鼠为皮质酮)等应激激素的分泌。糖皮质激素(GCs)通过与糖皮质激素受体(GR)结合形成受体-配体复合物,进而调控基因表达。研究表明,慢性压力会显著增加癌症患者的转移风险和生存率下降。在小鼠实验中,长期压力还会促进原发肿瘤生长,增强治疗抵抗性,并导致弥散性癌细胞(DCCs)的转移定植。虽然压力可能通过增强癌细胞的增殖、迁移和向远处组织转移的能力来促进转移,但被定植的组织也必须通过建立促转移微环境来支持DCCs的生长。一个关键的问题仍然存在:宿主因压力而发生的变化会影响转移吗?
中性粒细胞与淋巴细胞比值升高表明先天免疫细胞与适应性免疫细胞之间的平衡失调,这与乳腺癌及其他癌症的不良预后相关。这种升高的比值在经历应激反应的动物和人体内同样存。在转移性组织微环境中,T淋巴细胞可使转移灶保持休眠状态,而中性粒细胞则会促进转移。中性粒细胞的促转移作用包括抑制T细胞介导的免疫监视,以及形成中性粒细胞胞外诱捕网(NETs),即一种由DNA包裹中性粒细胞蛋白构成的网状结构。NETs通常在应对病原体时释放,但其本身也具有促转移功能,包括促进癌细胞迁移和侵袭、重塑细胞外基质(ECM),以及刺激成纤维细胞和免疫细胞。本研究通过小鼠模型,旨在探究慢性应激如何影响中性粒细胞以促进转移。解决压力如何诱导转移对于识别癌症复发风险患者和开发转移预防策略至关重要。

1 .慢性应激促进转移
为了确定慢性应激对癌症进展的影响,我们首先采用了经典的慢性束缚应激模型,该模型可模拟癌症诊断后出现的可预测、持续性应激。每日对小鼠进行束缚会使其血浆皮质酮水平升高,且这种升高依赖于肾上腺(图S1A)。随后,我们对两种小鼠模型进行慢性束缚应激处理:一种是会发展成乳腺癌的转基因MMTV-PyMT小鼠,另一种是通过原位移植MMTV-PyMT小鼠乳腺癌细胞(以下简称“PyMT细胞”)建立模型的小鼠。研究从肿瘤首次可触及时开始追踪(图1A和S1B)。长期应激反应使肿瘤体积增大近一倍,转移灶数量增加2-4倍(图1B、1C、S1C、S1D)。此外,原发肿瘤的免疫微环境呈现显著变化:T细胞、B细胞、自然杀伤(NK)细胞及活化巨噬细胞的浸润显著减少,而中性粒细胞的浸润则明显增加(图S1E和S1F)。在原位胰腺癌模型中,慢性约束应激使脾脏转移率增加了5倍以上(图S1G-J)。为模拟癌症患者因治疗反应或经济压力等不可预测因素产生的应激状态,我们采用了慢性不可预测轻度应激(CUMS)模型:通过静脉注射将弥散性PyMT细胞移植至肺部(即实验性转移模型)后,每天随机施加两种应激源(图S1K),导致血浆皮质酮水平升高(图S1L)。小鼠还表现出与慢性应激暴露相符的焦虑样行为改变,具体表现为:开放场地测试中静心区停留频率和时长减少,而高架十字迷宫测试中封闭臂内的停留频率和时长增加(图S1M、S1N)。最后,暴露于CUMS的小鼠,其肺部转移灶增加了一倍(图1D-1G)。因此,慢性束缚应激模型和CUMS模型在促进转移的能力方面具有可比性。在两种应激模型中观察到的皮质酮水平升高,以及先前关于皮质酮促进肿瘤转移作用的研究报道,促使我们验证皮质酮是否足以引发转移。我们通过移植携带原发性PyMT细胞的小鼠来完善转移模型,使肿瘤在手术切除前能够自然扩散(图1H)。在原发肿瘤被切除后,与安慰剂组相比,植入缓释型皮质酮微球显著增加了转移病灶数量及总体转移负荷(图1I-K)。皮质酮可通过激活癌细胞中的酪氨酸激酶ROR1促进乳腺癌转移。为探究应激诱导的皮质酮是否通过直接影响癌细胞而促进转移,我们利用CRISPR/Cas9技术对编码糖皮质激素受体(GR)的Nr3c1基因进行编辑,构建了GR缺失的PyMT细胞系(图S2A)。在正常培养条件下,或添加皮质酮及合成糖皮质激素地塞米松(Dex)的培养体系中,敲除GR基因均未影响癌细胞的体外增殖能力(图S2B-D)。亲本PyMT细胞的增殖也未受皮质酮或Dex补充的影响(图S2E)。值得注意的是,慢性应激仍会加剧GR缺失的PyMT细胞转移(图S2F-H),且Nr3c1-null PyMT细胞系的转移灶中未观察到对GR缺失细胞的选择性淘汰(图S2I)。综合结果表明,慢性应激可独立于癌细胞GR表达水平,直接促进导管原位癌(DCC)的转移。
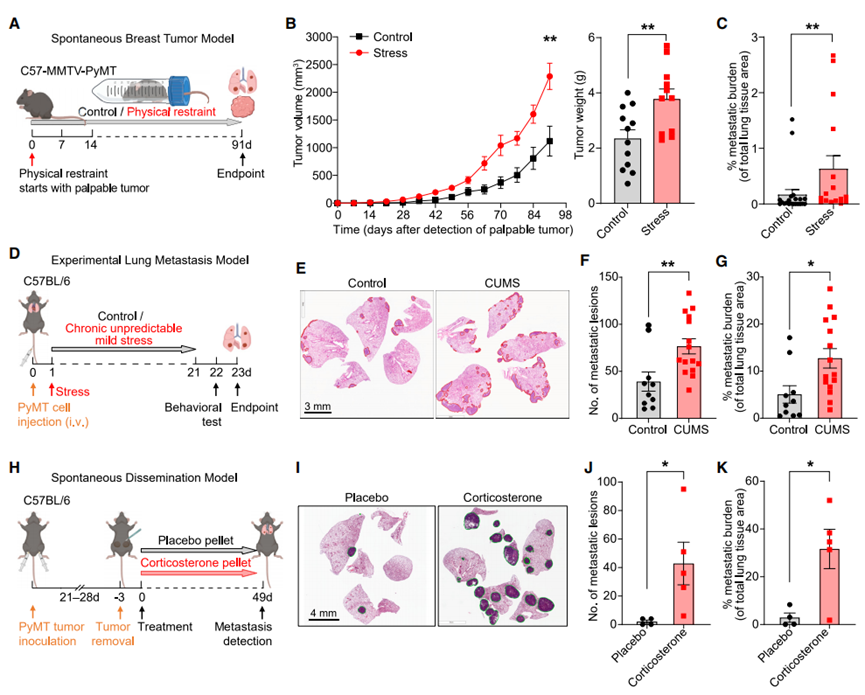
图1 慢性应激促进转移。
A:MMTV-PyMT乳腺肿瘤模型束缚应激暴露示意图
B:原发性MMTV-PyMT肿瘤的肿瘤生长曲线(左图)(对照组n=10,应激组n=16)和肿瘤重量(右图,终点)(对照组n=12,应激组n=11)。图中所示的肿瘤体积/重量为每只小鼠所有肿瘤的总体积/重量。
C:露于慢性束缚应激的MMTV-PyMT小鼠及其对照组(对照组n=21,应激组n=16)的肺转移负担。
D:实验性肺转移模型慢性不可预测性轻度应激(CUMS)暴露示意图。
E-G:终点时CUMS暴露后肺切片的H&E染色(E)、肺转移病灶数量(F)和总转移负荷(G)(对照组n=10,应激组n=15)。(H)自发播散模型中皮质酮颗粒治疗的示意图。(I)来自(H)的终点时肺部代表性H&E染色。
J-K:来自(H)的肺转移病灶数量(J)和总转移负荷(K)(n=5只小鼠/组)。
注:数据以均值±标准误表示。* P<0.05;** P<0.01 (B、F、G、J、K:双尾非配对t检验;C:双尾曼-惠特尼检验)。另见图S1和S2。
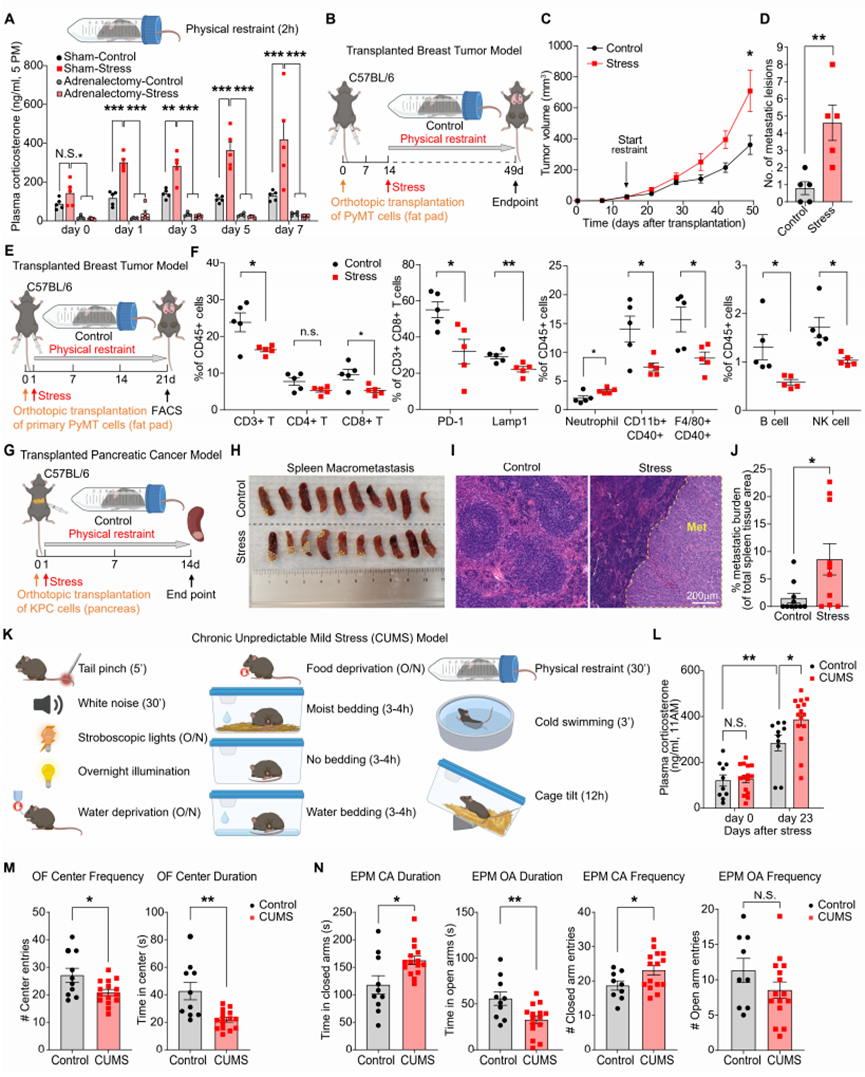
图S1
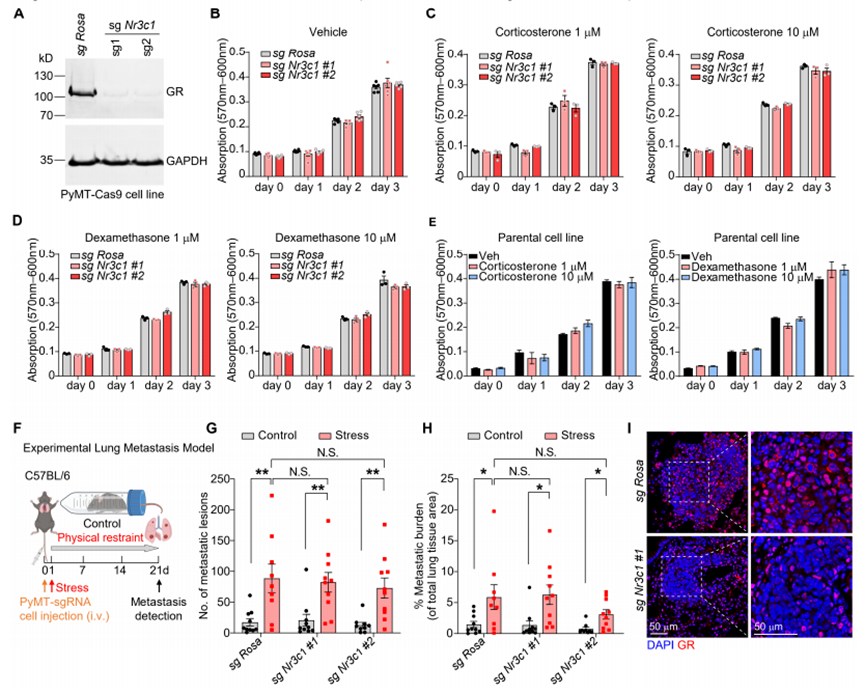
2 .慢性压力促发促转移微环境形成
鉴于癌细胞中的糖皮质激素受体(GR)在应激诱导的转移中未发挥作用,我们推测微环境的改变对这种转移至关重要。为了明确此类变化,我们通过bulk RNA测序(RNA-seq)对处于慢性应激状态的小鼠肺脏进行了分析。基因本体论(GO)分析显示,与对照组相比,应激状态显著上调了与细胞外基质(ECM)组织相关的基因表达,同时下调了参与T细胞活化和适应性免疫应答的基因(图2A和S3A)。与GO分析结果一致,暴露于应激的小鼠或经皮质酮、地塞米松(Dex)处理的小鼠,其肺脏中具有促转移作用的细胞外基质蛋白,即纤连蛋白的沉积显著增加(图2B、S3B和S3C)。通过免疫荧光实验,我们发现慢性应激小鼠肺脏中的纤连蛋白与表达成纤维细胞标志物α-SMA(平滑肌肌动蛋白)和PDGFR(血小板衍生生长因子受体)-α相关(图S3D)。同样与GO分析结果相符的是,慢性应激小鼠肺脏中T细胞的浸润减少(图2C和S3E)。然而,在T细胞条件性敲除GR的小鼠(GRΔT小鼠:Lck-icre;Nr3c1fl/fl 小鼠)中,应激诱导的肺转移并未减少(图2D、2E、S3F和S3G)。
促转移微环境的一个共同特征是髓系来源细胞的浸润,尤其是中性粒细胞。在应激小鼠的肺脏中,我们观察到两种介导中性粒细胞募集的趋化因子(Cxcl2和Cxcl5)的mRNA 水平和蛋白水平均有所升高(图S3H和S3I)。与此一致的是,慢性束缚应激或糖皮质激素处理使肺脏中中性粒细胞的浸润增加,同时也提高了血液中中性粒细胞的比例(图2F、2G、S3J和S3K)。在慢性应激暴露期间,骨髓中的干细胞和祖细胞群(Lin⁻/Sca1⁺/c-Kit⁺细胞以及粒-单核细胞祖细胞)也随之扩增(图S3L)。抗生素处理并未影响应激小鼠肺脏中中性粒细胞、单核细胞、树突状细胞或总T细胞的浸润,尽管观察到γδ T细胞的浸润有所减少(图S3M和S3N)。这一结果表明,免疫细胞浸润的变化并非由应激诱导的免疫抑制所引发的感染导致。
当适应性免疫反应减弱时,树突状细胞(DCCs)可能形成转移灶。为探究中性粒细胞与T细胞是否存在相互作用,我们采用两种处理方式:将CD8+ T细胞与经GR激动剂(GSK9027)药理学激活或载体处理的中性粒细胞共孵育过夜,以观察抗CD3诱导的T细胞活化效应(包括CD69、CD137、颗粒酶B及IFN-γ表达水平)。实验结果显示,经GSK9027处理的中性粒细胞未能激活T细胞,而载体处理组则能有效激活(图2H和2I)。值得注意的是,经GSK9027处理的中性粒细胞分泌了多种细胞因子水平的升高,其中包括白细胞介素(IL)-10(图S3O),这种物质是已知的T细胞活化抑制剂。最后,我们通过在肺转移瘤实验模型中清除中性粒细胞来探究其体内重要性(图2J和S3P)。在清除中性粒细胞的小鼠模型中,应激暴露不再促进转移灶形成(图2K)。综合这些数据表明,慢性应激会诱导促转移的肺微环境形成,而中性粒细胞在调控应激诱导的转移过程中起着关键作用。
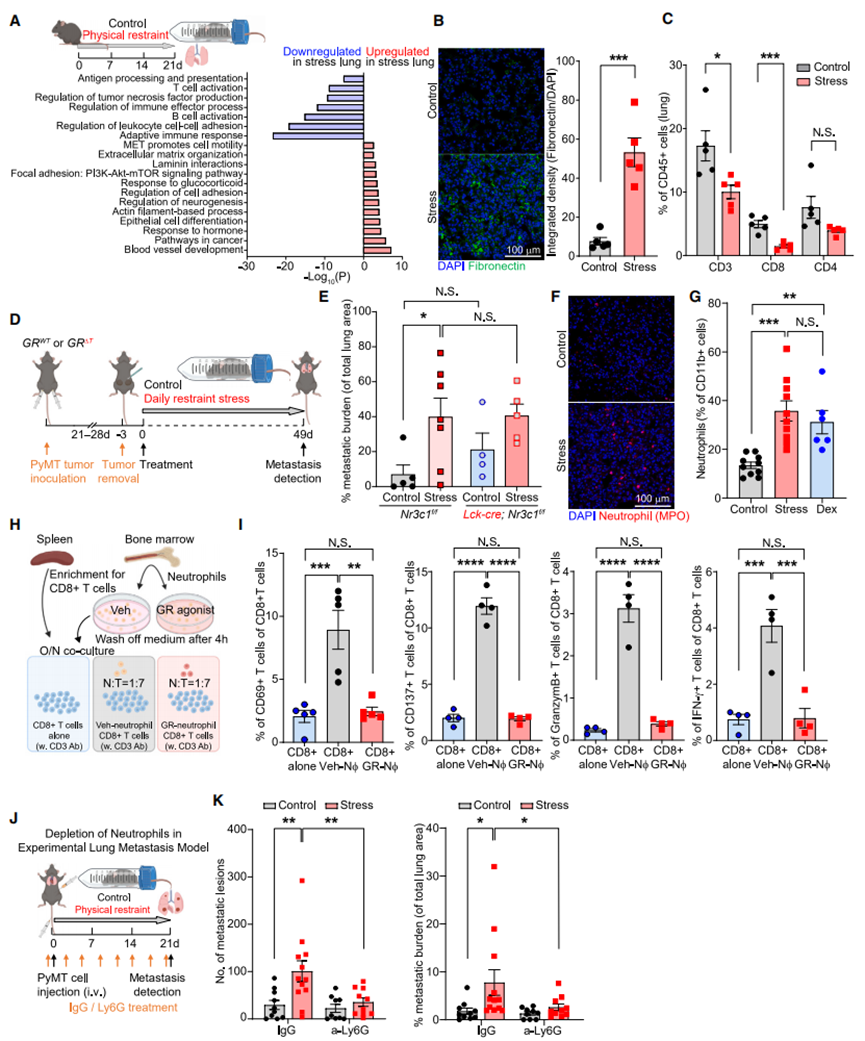
图2慢性应激建立促转移性肺微环境
A:对照组和应激组小鼠肺组织中富集通路的基因本体论(GO)术语分析(批量RNA测序;n=2只小鼠/组)。
B:实验第21天,肺组织中纤连蛋白的代表性免疫荧光染色(左图)和标准化积分密度(IntDen)。DAPI对DNA进行染色(n=5只小鼠/组)。
C:实验第21天,用流式细胞术测定肺组织中的T细胞群(n=5只小鼠/组)。
D:用于(E-G)的自发性乳腺癌播散模型中慢性束缚应激暴露示意图。
E:应激暴露终点时,所示基因型小鼠的总转移负担(每组 n=4-7只小鼠)。
F-G:第21天肺中性粒细胞浸润(F,髓过氧化物酶[MPO]免疫荧光染色,DAPI复染;G,流式细胞术;对照组和应激组小鼠10只,Dex组小鼠6只)。
H:中性粒细胞-CD8+ T细胞共培养实验示意图。
I:流式细胞术测定中性粒细胞共培养物中活化CD8+ T细胞的百分比(以CD69、CD137、颗粒酶B或IFN-γ的表达表示)(H)(每组5只小鼠)。
J:中性粒细胞耗竭的实验性肺转移模型中慢性束缚应激暴露示意图。
K:应激暴露和抗Ly6G抗体去除中性粒细胞后的肺转移性病变和总转移负担(n=9-12只小鼠/组)。
注:数据表示为平均值±标准差(SEM)。*P<0.05;**P<0.01;***P<0.001;****P<0.0001;N.S.表示差异不显著(B、C:双尾非配对t检验;E、G、K:采用Dunnett多重比较检验的单因素方差分析;I:采用Tukey多重比较检验的单因素方差分析)。另见图S3。
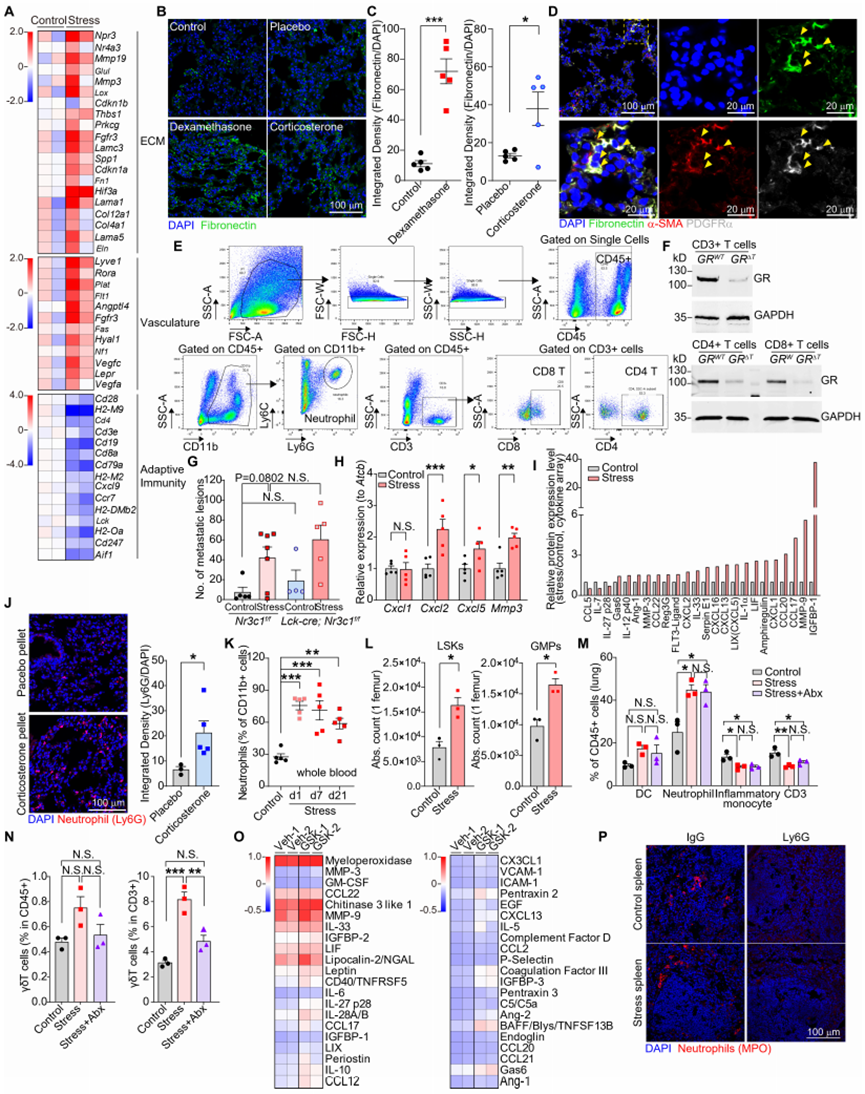
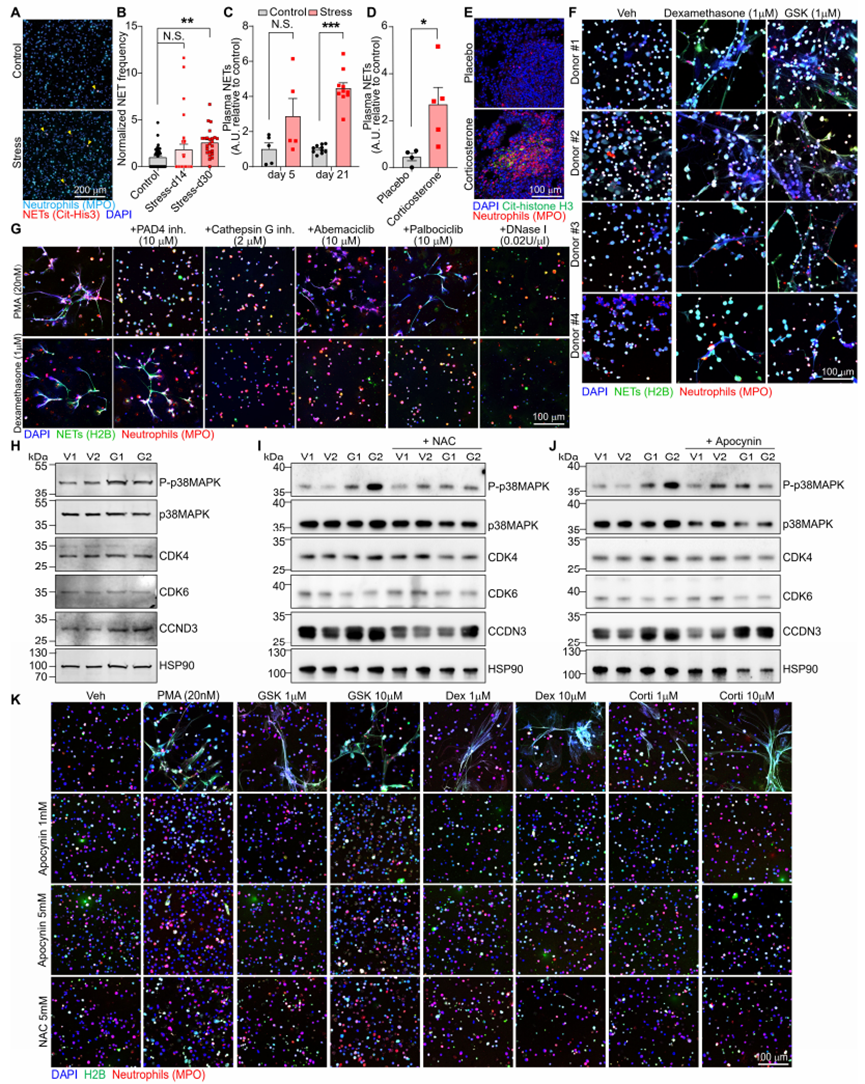
3 .压力通过糖皮质激素受体信号通路改变中性粒细胞的昼夜老化过程并诱导NETs形成
为探究应激如何通过影响中性粒细胞来驱动转移,我们分析了从应激小鼠肺脏中分离出的中性粒细胞的基因表达变化(图S4A)。许多显著上调的基因(如Zbtb16、Map3k6、Hif3a和Fkbp5)与经地塞米松(Dex)或GSK9027处理的骨髓来源中性粒细胞中上调的基因存在重叠(图S4A和S4B)。此外,基因集富集分析显示,从应激小鼠肺脏中分离出的中性粒细胞,其基因特征与体外经Dex或GSK9027处理的中性粒细胞的基因特征显著上调(图S4C-S4F)。这些发现表明,暴露于应激的小鼠其体内中性粒细胞的基因表达变化主要由糖皮质激素(GCs)引起。因此,我们利用体外经GSK9027处理的中性粒细胞,通过染色质免疫沉淀测序(ChIP-seq)(图S4G)及染色质免疫沉淀定量 PCR(图S4H)验证发现,糖皮质激素受体(GR)被招募到多个显著上调基因的位点,包括Zbtb16、Per1、Fkbp5和Map3k6。
地塞米松处理可上调中性粒细胞中与生物钟及氧化应激反应相关的基因(图3A)。中性粒细胞的表型和行为会发生显著的昼夜波动,包括在迁移和中性粒细胞胞外诱捕网(NETs)形成方面,这些变化受其细胞内在时钟以及趋化因子CXCL12的振荡性微环境表达调控。我们发现,糖皮质激素受体可直接调控中性粒细胞中关键时钟基因Per1的表达(图S4G和S4H)。血浆皮质酮水平会发生昼夜变化(图S5A),中性粒细胞中Nr3c1 mRNA和糖皮质激素受体蛋白的表达亦是如此(图S5B和S5C)。慢性应激暴露改变了血液中中性粒细胞数量的正常昼夜波动,使其数量峰值比正常情况提前小时出现(图S5D)。此外,在昼夜周期的大部分时间里,应激小鼠体内中性粒细胞占所有白细胞的比例均高于对照小鼠(图S5E)。慢性应激还改变了中性粒细胞上与迁移/衰老相关的表面标志物的表达(图S5和S5G)。因此,我们对参与调控中性粒细胞昼夜衰老过程的关键基因进行了检测,这些基因是中性粒细胞活动昼夜波动的基础。地塞米松处理可增加时钟相关基因(尤其是Per1和Per2)的表达,并诱导中性粒细胞昼夜衰老标志物的基因表达变化(低Cxcr2和高Cxcr4,图3B),这表明其出现了异常的“衰老”表型。在从应激小鼠肺脏中分离出的中性粒细胞中,也观察到了类似的时钟相关基因表达变化(图S5H)。在蛋白水平上,应激小鼠血液中的中性粒细胞表现出CXCR4表达增加和CD62L表达减少,这与昼夜“衰老”表型一致(图S5I和S5J),而经地塞米松或皮质酮处理的小鼠,其体内中性粒细胞的CD62L表达减少(图S5K和S5L)。值得注意的是,高肿瘤负荷会改变中性粒细胞的表型,在荷瘤动物中,应激暴露并未进一步改变中性粒细胞衰老标志物的表达(图S5M)。
CD62L低表达的中性粒细胞会产生更多的活性氧(ROS)。与此一致的是,我们观察到经GSK9027处理的中性粒细胞中,氧化相关基因表达上调,抗氧化基因表达下调(图3C),且细胞内活性氧水平升高(图S5N)。活性氧水平升高的中性粒细胞更易形成NETs,且氧化基因(如Ncf1)可调控NETs的形成。我们发现,与对照小鼠相比,应激小鼠的循环中性粒细胞在体外可自发形成更多的NETs(图S6A和S6B)。我们还检测到,慢性应激小鼠血浆中的NETs数量多于对照小鼠(图3D和S6C)。此外,在应激暴露前已行肾上腺切除术的慢性应激小鼠中,其血浆中性粒细胞胞外诱捕网水平并未升高(图3D),且经皮质酮处理的小鼠,其血浆和肺脏中的中性粒细胞胞外诱捕网水平均有所增加(图S6D 和S6E)。综上,这些数据表明,应激期间释放的糖皮质激素会导致NETs的形成。
为确定糖皮质激素是否可直接诱导中性粒细胞胞外诱捕网的形成,我们从骨髓中分离出中性粒细胞并在体外对其进行刺激。与经典的中性粒细胞胞外诱捕网诱导剂—佛波醇12-肉豆蔻酸酯13-乙酸酯(PMA)类似,皮质酮、地塞米松和GSK9027均能诱导中性粒细胞胞外诱捕网的形成,而应激期间同样会释放的肾上腺素则不能(图3E和3F)。糖皮质激素还能诱导健康人类供体的中性粒细胞形成中性粒细胞胞外诱捕网(图S6F)。接下来,我们试图阐明介导糖皮质激素诱导中性粒细胞胞外诱捕网形成的信号通路。与佛波醇12-肉豆蔻酸酯13-乙酸酯诱导的中性粒细胞胞外诱捕网不同,糖皮质激素诱导的中性粒细胞胞外诱捕网不需要肽基精氨酸脱亚胺酶4(PAD4)的活性(图3G和S6G)。中性粒细胞胞外诱捕网的形成可受细胞周期蛋白依赖性激酶4和6(CDK4/6)调控,且GSK9027可诱导糖皮质激素受体在Ccnd3基因位点的占据,Ccnd3基因编码细胞周期蛋白D3(CCDN3),而细胞周期蛋白D3是细胞周期蛋白依赖性激酶4/6的调节剂(图S4G 和S4H)。我们进一步确定,经GSK处理的中性粒细胞中CCDN3蛋白表达上调(图S6H)。除了细胞周期蛋白D3介导的调控外,丝裂原活化蛋白激酶(MAPK)信号也可调控细胞周期蛋白依赖性激酶4/6的活性,我们发现,经GSK处理的中性粒细胞中,p38丝裂原活化蛋白激酶的磷酸化(指示激酶活化)增加(图S6H)。这些数据与GSK诱导糖皮质激素受体结合到Map3k6基因位点的结果一致(图S4G和S4H),Map3k6基因编码激酶ASK2,而ASK2是p38丝裂原活化蛋白激酶的上游激活剂。因此,我们测试了两种细胞周期蛋白依赖性激酶4/6抑制剂(阿贝西利和帕博西尼)以及一种转录活性抑制剂(α-鹅膏蕈碱),发现它们能有效阻止糖皮质激素诱导的中性粒细胞胞外诱捕网形成(图3G 和S6G)。此外,糖皮质激素诱导的中性粒细胞胞外诱捕网还依赖于组织蛋白酶G的活性(图3G和S6G)。再者,通过使用两种不同的活性氧抑制剂,我们发现活性氧是糖皮质激素诱导中性粒细胞胞外诱捕网形成、p38丝裂原活化蛋白激酶磷酸化及细胞周期蛋白D3上调所必需的(图S6I-S6K)。综上,我们的数据提出了一种模型:糖皮质激素诱导的活性氧可导致细胞周期蛋白D3上调和p38丝裂原活化蛋白激酶磷酸化,共同增强细胞周期蛋白依赖性激酶4/6的活性,最终导致中性粒细胞胞外诱捕网的形成。
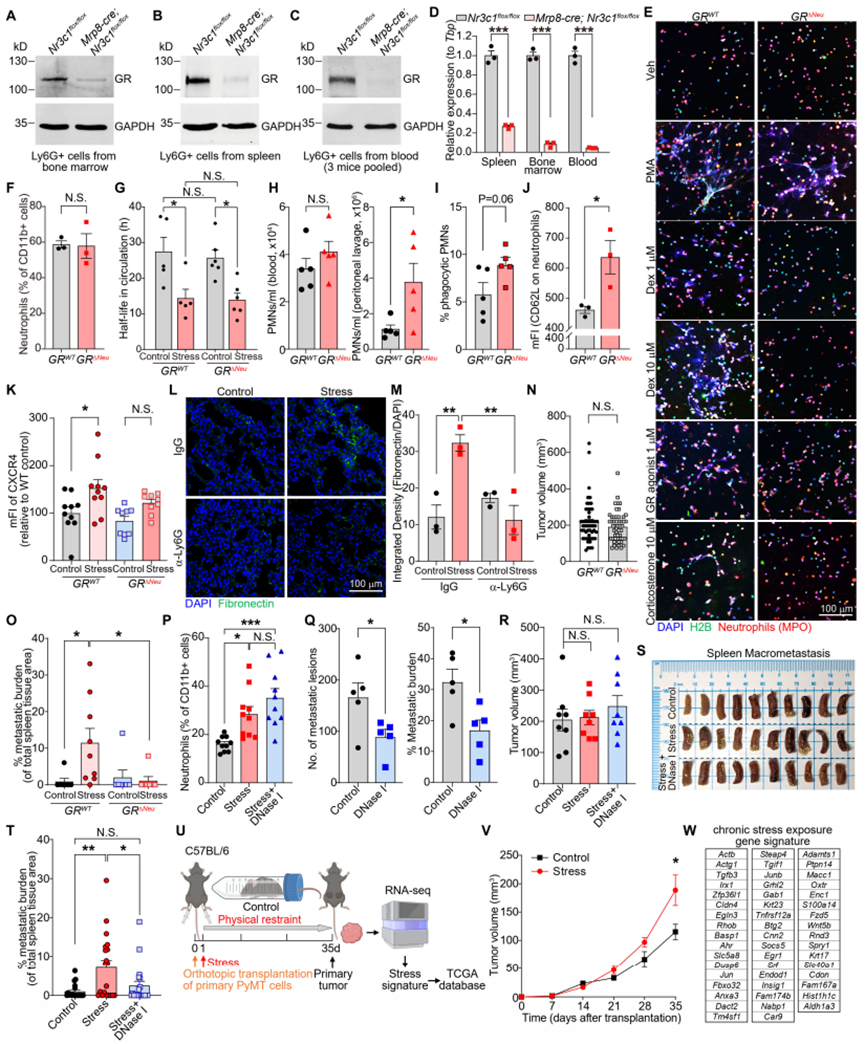
为确定中性粒细胞糖皮质激素受体信号在体内中性粒细胞胞外诱捕网形成中的重要性,我们构建了中性粒细胞中糖皮质激素受体条件性敲除的小鼠:Mrp8-cre;Nr3c1fl/fl小鼠(以下简称“GRΔNeu小鼠”)(图S7A-S7D)。与同窝出生的GRWT(Nr3c1fl/fl)对照小鼠的中性粒细胞相比,暴露于应激的GRΔNeu小鼠的中性粒细胞在体外不会自发形成更多的中性粒细胞胞外诱捕网(图3H)。此外,皮质酮、地塞米松和GSK9027均无法诱导GRΔNeu小鼠的中性粒细胞形成中性粒细胞胞外诱捕网(图3I和S7E)。总之,我们的研究结果表明,糖皮质激素-糖皮质激素受体信号可改变中性粒细胞的基因表达,导致异常的昼夜衰老表型,并在慢性应激期间增加自发性NETs的形成。
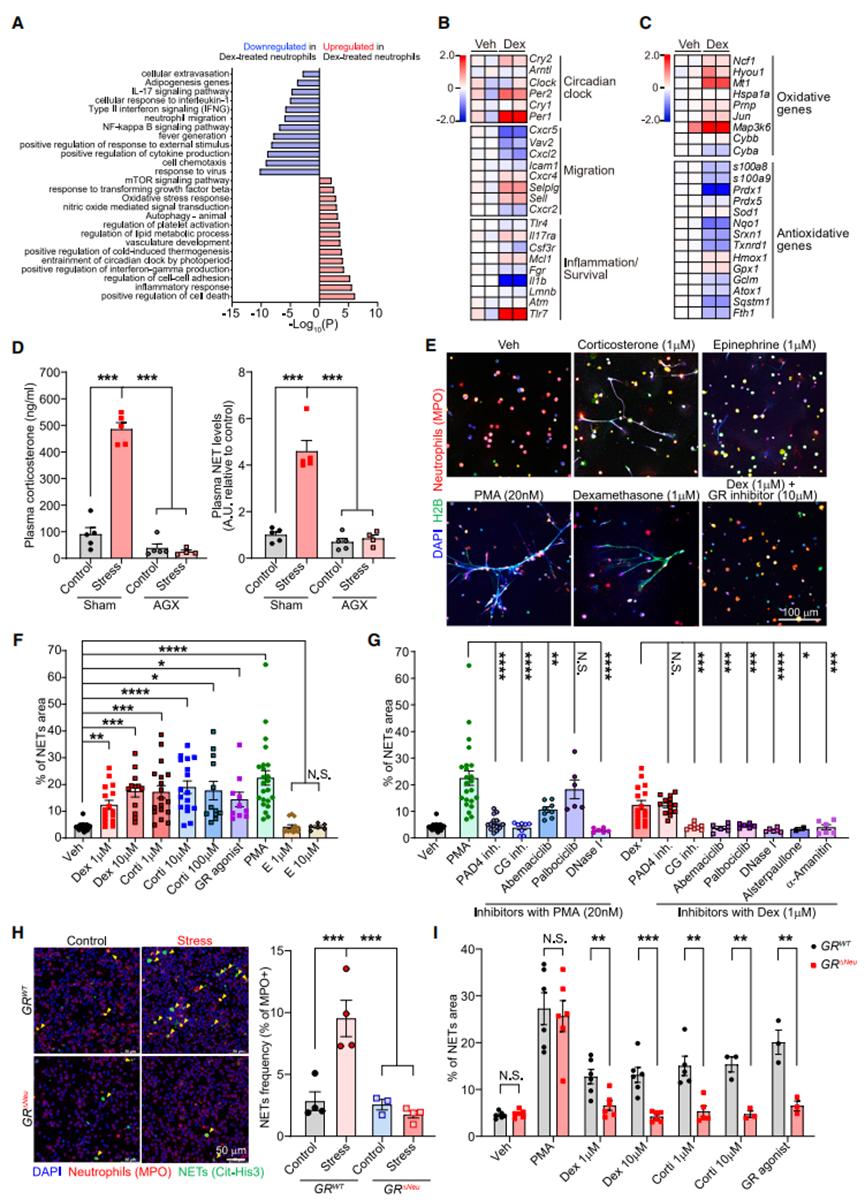
图3糖皮质激素通过GR诱导NETs
A:对接受或未接受地塞米松(Dex)治疗4小时的骨髓来源性中性粒细胞进行基因本体(GO)术语富集通路分析(n=2个生物学重复)。
B-C:热图展示了选定基因的分布情况,其中B包含昼夜节律基因及与迁移、炎症/生存相关的基因,C则为氧化应激相关基因。颜色标尺表示转录本每百万倍数(TPM)的log2倍变化值。每个基因相对于对照样本平TPM的值(n=2个生物学重复,每个重复来自两只小鼠)。
D:对接受肾上腺切除术(AGX)或假手术(每组4-5只小鼠)的对照组和应激组小鼠血浆样本进行皮质酮(左)和去甲肾上腺素(NETs,右)的酶联免疫吸附试验(ELISA)分析。
E:通过抗MPO抗体和抗组蛋白H2B抗体的免疫荧光共染色法以及DAPI染色法评估NETs形成情况,对在指定条件下培养过夜的小鼠中性粒细胞进行检测(veh:溶媒).
F-G:小鼠中性粒细胞在不同培养条件下释放的中性粒细胞胞外诱捕网(NETs)数量(以NETs覆盖的视场百分比表示,数据点代表视场范围,中性粒细胞取自2-8只小鼠/组)。
H:在慢性束缚应激14天后,从指定基因型小鼠血液中分离的中性粒细胞体外培养物中自发形成的NETs(黄色箭头)[左:代表性免疫荧光染色结果;右侧为定量分析结果(每组4只小鼠)]。
I:将指定基因型小鼠的中性粒细胞按所示方法进行体外培养,并按照(E)和(F)中的方法评估和定量NETs形成(点表示FOV,中性粒细胞来自2只小鼠/组)。
注:数据以均值±标准误表示。*P<0.05;**P<0.01;***P<0.001;****P<0.0001;
- S.表示无统计学显著性(D、F、G、H:单因素方差分析结合邓尼特多重比较检验;I:双尾非配对t检验)。另见图S4-7。
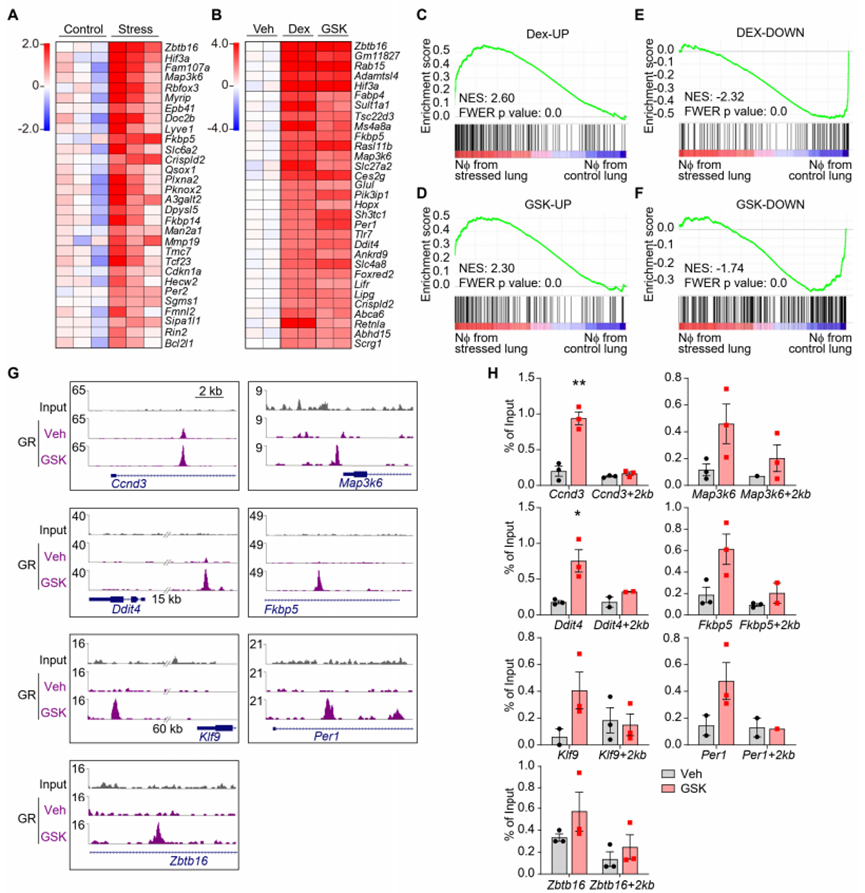
图S4
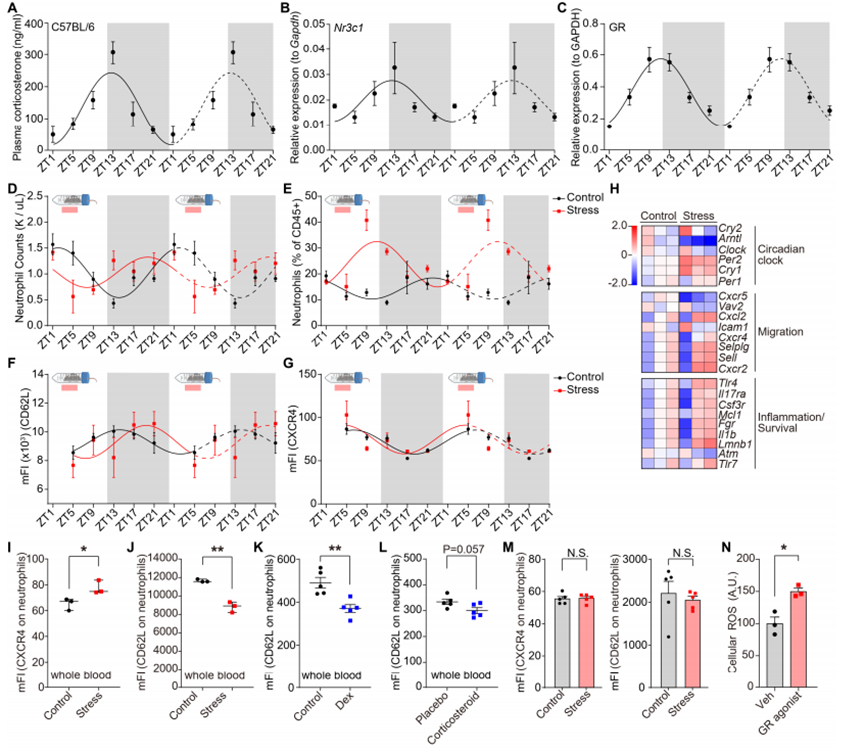
图S5
图S6
图S7
4 .靶向应激诱导的NETs可抑制转移
接下来,我们评估了糖皮质激素受体(GR)对中性粒细胞表型的其他影响。在正常条件下,中性粒细胞中GR的缺失并未改变血液中中性粒细胞的比例(图S7F)。此外,尽管慢性应激缩短了循环中性粒细胞的寿命,但这种效应并不依赖于GR(图S7G)。然而,GRΔNeu小鼠的中性粒细胞在体内表现出更强的迁移能力和吞噬能力(图S7H和S7I)。我们随后检测了衰老标志物的表达:野生型小鼠在慢性应激后CD62L水平降低(图S5J),而应激状态下 GRΔNeu小鼠的中性粒细胞CD62L表达显著高于同窝应激状态下的GRWT小鼠(图S7J)。相反,应激状态下GRWT小鼠的中性粒细胞 CXCR4 表达升高,而GRΔNeu小鼠在应激状态下CXCR4表达未显著升高(图S7K)。这些数据共同表明,GRΔNeu小鼠的中性粒细胞未像GRWT小鼠的中性粒细胞那样经历应激诱导的异常昼夜衰老。此外,慢性应激并未在GRΔNeu小鼠或中性粒细胞耗竭的野生型小鼠的肺中诱导纤连蛋白沉积(图4A、4B、S7L和S7M)。为了验证中性粒细胞GR是否为应激诱导转移所必需,我们向GRWT和GRΔNeu小鼠原位移植了原发性PyMT细胞,以允许癌细胞自发播散。在手术切除和应激暴露前,中性粒细胞中GR的缺失并不影响原发肿瘤的生长(图S7N)。然而,值得注意的是,中性粒细胞中GR的缺失消除了慢性应激诱导的乳腺癌播散性癌细胞(DCCs)的肺转移(图4C)以及胰腺癌向脾脏的转移(图S7O)。
考虑到NETs的促转移作用,以及在慢性应激小鼠中观察到的GR依赖性NETs水平升高,我们验证了NETs是否为应激诱导转移所必需。每日用可降解NETs的DNase I处理应激小鼠,可有效降低其肺和血浆中的NETs水平(图4D-4F)。此外,DNase I消除了应激诱导的肺内纤连蛋白沉积,且不影响中性粒细胞浸润(图4E、4F和S7P),这表明NETs是应激诱导纤连蛋白沉积所必需的。DNase I减少了非应激对照小鼠的实验性肺转移,证实了在PyMT模型中,无论NETs是否由应激诱导,均具有促转移作用(图S7Q)。在自发播散模型中(图4G),对手术切除时肿瘤大小相当的小鼠(图S7R),DNase I介导的NETs降解减少了应激诱导的肺转移:与应激对照小鼠肺中高度增殖的转移灶相比,经DNase I处理的应激小鼠肺中的播散性癌细胞大多不增殖(图4H),且DNase I显著减少了应激诱导的转移(图4H-4J)。同样,DNase I减少了应激诱导的胰腺癌向脾脏的转移(图S7S和S7T)。
据我们所知,尚无临床研究将应激、糖皮质激素(GC)水平和NETs与癌症患者的预后相关联。此类分析的一个主要障碍是血浆GC水平的昼夜波动:将血浆采集时间与患者个体的昼夜节律同步是不切实际的。为了探究应激暴露的分子指标与乳腺癌患者生存率之间的关联,我们构建了一个“慢性应激暴露”基因特征。由于我们对肺组织的RNA测序分析显示,应激诱导的通路和基因下调比上调更为显著(图2A),因此我们重点关注了下调的基因。该特征包含在对照小鼠和慢性束缚应激暴露小鼠的原发肿瘤对比中,前100个下调基因中表达量最高的50个基因(图S7U-S7W,更多细节见STAR方法)。我们发现,肿瘤表现出慢性应激暴露基因表达特征(即应激下调基因表达较低)的乳腺癌患者,其总生存率降低(图4K)。对于雌激素受体和孕激素受体阳性的乳腺癌患者,这种总生存率降低的现象尤为显著,但对于人表皮生长因子受体2阳性(p=0.059)或三阴性乳腺癌患者,这种差异未达到统计学显著性(图4K)。
总之,我们的数据表明,慢性应激暴露通过释放糖皮质激素驱动转移。这些糖皮质激素通过诱导中性粒细胞形成NETs,建立了一个促转移的微环境。
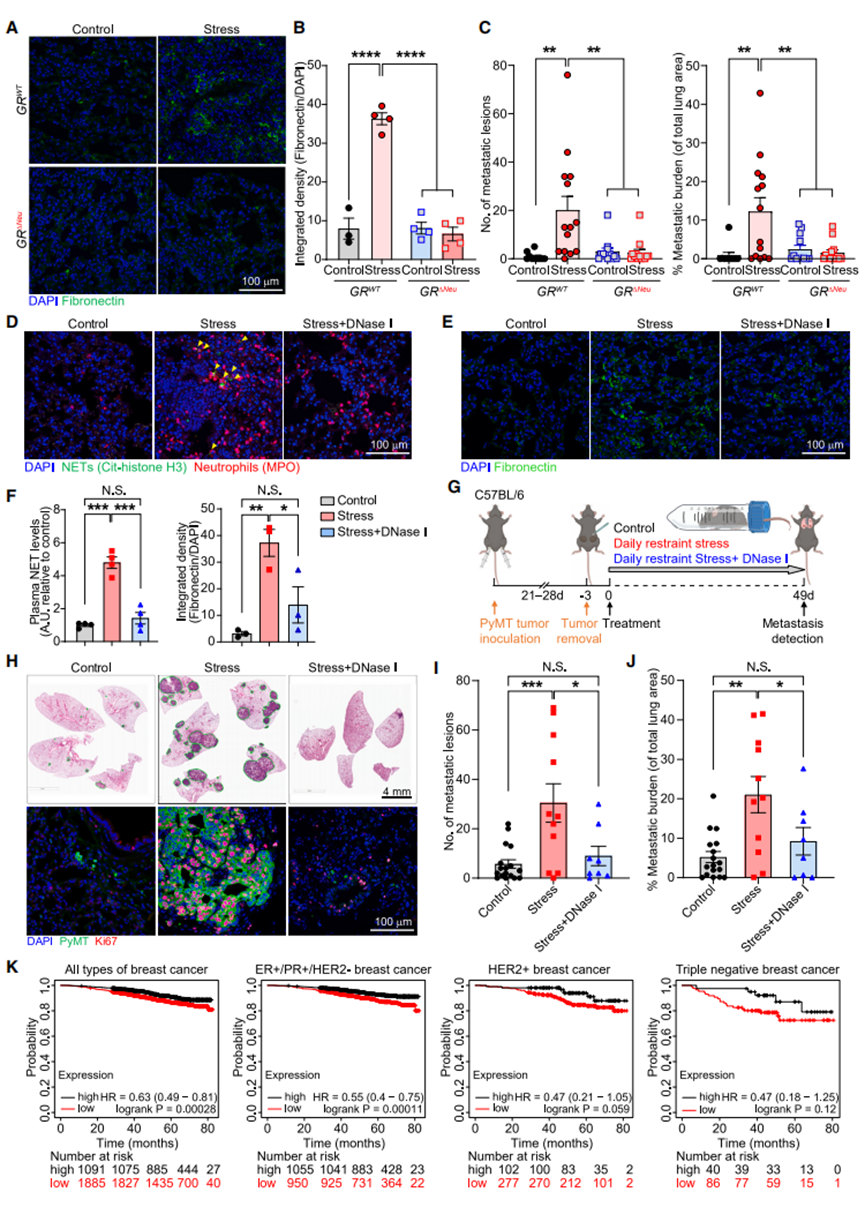
图4 糖皮质激素诱导的NETs是应激性肺转移的必要条件
A-B:具有指定基因型的小鼠肺组织中代表性纤连蛋白免疫荧光染色(A)和染色定量(B),分别接受或未接受21天慢性束缚应激(n=3-4只小鼠/组)。
C:采用自发播散模型,随后接受49天慢性束缚应激,检测具有指定基因型的小鼠的肺转移病灶数量和肺转移总负担(实验设计如图2D所示;n=10-14只小鼠/组)。
D-F:通过免疫荧光染色检测小鼠肺组织中应激诱导的NETs形成(D)(黄色箭头表示NETs;在原发性肿瘤切除后24天对肺进行分析)。(E)非荷瘤小鼠肺组织中代表性纤连蛋白免疫荧光染色,按指示处理21天。(F)按(G)所示处理小鼠的NETs血浆水平(左)和肺组织纤连蛋白表达(右)(左:n=4只小鼠/组;右:n=3只小鼠/组)。
G:自发播散模型联合慢性束缚应激和DNase I治疗示意图。
H-J:(H)终点时肺组织中增殖(Ki67+)PyMT癌细胞(下排)的代表性H&E染色(上排)和免疫荧光染色(见G)。(I)肺转移性病变和(J)终点时的总转移负担(见G)(n=8-17只小鼠/组)。
(K)使用Kaplan-Meier绘图仪(http://www.kmplot.com/,n在每个图中均标明,亚型在图中均有说明)的数据,绘制了具有高(黑线)或低(红线)“慢性应激暴露基因标记”的乳腺癌患者总生存期的Kaplan-Meier图,并按亚型划分。
注:数据表示为平均值±SEM。*P<0.05;**P<0.01;***P<0.001;****P<0.0001;N.S.表示不显著(B:采用 Dunnett 多重比较检验的单因素方差分析;C、F、G、I、J:采用 Tukey 多重比较检验的单因素方差分析)。另见图S7

在此,我们利用两种广泛应用于应激相关疾病研究的小鼠模型,证实了慢性应激会增加转移风险。应激诱导转移的一个关键驱动因素是糖皮质激素(GCs),其通过作用于中性粒细胞发挥作用。这一发现与先前的研究报道一致,即糖皮质激素水平升高会促进转移和免疫功能障碍。我们发现NETs是应激诱导转移的关键因素。重要的是,乳腺癌患者肺和肝脏中NETs的存在与后续转移的发生相关,目前已明确NETs通过多种并行机制促进转移。
我们的研究表明,糖皮质激素受体(GR)是应激诱导NETs形成所必需的,并在中性粒细胞中鉴定出多个由糖皮质激素激活的下游靶基因。目前尚不清楚哪些糖皮质激素受体靶基因介导NETs的形成,但我们注意到,细胞周期蛋白依赖性激酶4/6(CDK4/6)抑制剂、组织蛋白酶G抑制剂和活性氧(ROS)抑制剂均能阻断糖皮质激素诱导的NETs形成。经典观点认为,肽基精氨酸脱亚胺酶4(PAD4)是NETs形成所必需的,但抑制PAD4对糖皮质激素诱导的NETs无影响,这与先前的一项报道一致,即中性粒细胞可独立于PAD4促进应激诱导的转移。
应激对中性粒细胞有多方面影响。循环中中性粒细胞占白细胞的比例增加,骨髓中的髓系祖细胞群扩大。应激对中性粒细胞的其他影响还包括异常的昼夜节律和NETs形成增加;未来需要研究中性粒细胞(可能还有其他免疫细胞)的异常昼夜节律是否会促进转移。观察到的大多数应激效应(包括NETs形成)均依赖于中性粒细胞中糖皮质激素受体的表达。然而,慢性应激诱导的中性粒细胞寿命缩短并不依赖于糖皮质激素受体,这表明慢性应激除了通过激活糖皮质激素受体外,还通过其他机制影响宿主。值得注意的是,糖皮质激素的作用可能具有细胞类型依赖性,例如,它可抑制某些细胞类型的胞内活性氧生成,却会增加中性粒细胞(本研究)、癌细胞、软骨细胞和海马组织中的活性氧生成。
在转移微环境中,适应性免疫系统可阻止癌细胞形成转移灶。先前研究表明,糖皮质激素可通过减少T细胞浸润发挥促肿瘤作用,但我们发现,糖皮质激素并非通过直接作用于T细胞来促进应激诱导的转移。相反,糖皮质激素刺激的中性粒细胞可能会抑制细胞毒性T细胞的活化,这一观点得到了先前研究的支持,即中性粒细胞可通过抑制T细胞介导的免疫监视来促进转移。除了具有免疫抑制作用外,促转移微环境还具有血管通透性增加、骨髓来源细胞募集和细胞外基质(ECM)改变等特征。在应激动物的肺中,我们观察到纤连蛋白的蓄积,而纤连蛋白会促进骨髓来源细胞和癌细胞在促转移微环境中的黏附。我们发现,应激诱导的肺中纤连蛋白表达与成纤维细胞相关,但具体依赖于中性粒细胞中糖皮质激素受体的表达和NETs的存在。这一结果表明,NETs会刺激成纤维细胞分泌纤连蛋白。因此,靶向NETs可能对肺微环境产生广泛的正常化作用。此外,降低慢性应激期间观察到的血浆NETs水平升高可能也有益处,因为血液中的NETs可支持循环癌细胞、损伤内皮并导致血栓形成。
与慢性应激相似,细胞老化也与癌症进展和慢性炎症密切相关,这种现象被称为“炎性老化(inflammaging)”。值得注意的是,炎性老化与慢性应激共享许多表型特征,如肠道通透性增加、细胞衰老及免疫功能紊乱等。此外,来自老年小鼠的中性粒细胞(如同应激小鼠)在体外具有更高的NETs自发形成能力。这些相似性表明,NETs在老年癌症患者中也可能成为重要的干预靶点,其意义超越了应激本身。
综上所述,我们的研究强烈提示,减少癌症患者的心理应激应作为肿瘤治疗的重要组成部分。此外,本研究也对临床广泛使用的合成类糖皮质激素提出了警示:这些药物常用于缓解化疗副作用和治疗晚期癌症症状,但在小鼠模型中已有大量证据表明,GCs可促进肿瘤转移、降低治疗反应。因此,应进一步深入研究慢性应激和GCs使用是否会对癌症患者生存产生不利影响。
参考文献:
He XY, Gao Y, Ng D, Michalopoulou E, George S, Adrover JM, Sun L, Albrengues J, Daßler-Plenker J, Han X, Wan L, Wu XS, Shui LS, Huang YH, Liu B, Su C, Spector DL, Vakoc CR, Van Aelst L, Egeblad M. Chronic stress increases metastasis via neutrophil-mediated changes to the microenvironment. Cancer Cell. 2024 Mar 11;42(3):474-486.e12. doi: 10.1016/j.ccell.2024.01.013. Epub 2024 Feb 22. PMID: 38402610; PMCID: PMC11300849.

 健康教育网
健康教育网












